引言:超越传统,聚焦“新兴益生元”的前沿版图
近年来,益生元领域的科学共识经历了深刻的演变。其定义已不再局限于传统上对乳酸杆菌 (Lactobacillus) 和双歧杆菌 (Bifidobacterium) 的选择性促进作用,而是扩展至一个更广阔的微生物响应范围,涵盖了如罗斯氏菌 (Roseburia)、真杆菌 (Eubacterium)、艾克曼菌 (Akkermansia) 及普拉梭菌 (Faecalibacterium) 等一系列新兴的健康促进菌属。这一范式转移至关重要,因为这些新靶点是短链脂肪酸(SCFAs)的强效生产者,而SCFAs对调节胃肠道功能、免疫、炎症、糖脂代谢乃至能量消耗等具有系统性的健康益处。
在此背景下,“新兴益生元” (Emerging Prebiotics) 的概念应运而生。它突破了传统果寡糖(FOS)和半乳寡糖(GOS)的范畴,囊括了木寡糖(XOS)、异麦芽寡糖(IMO)、果胶寡糖(POS)、甘露寡糖(MOS)、壳寡糖(CHOS)等新型碳水化合物分子。更具革命性的是,该定义进一步纳入了非碳水化合物物质,特别是多酚类化合物。同时,益生元的作用靶点也从肠道菌群延伸至皮肤菌群,为化妆品和皮肤病学领域开辟了全新的应用前景。
这一领域的快速发展不仅源于对人类健康的深入探索,也与两大全球趋势——个性化健康与可持续循环经济——的交汇密不可分。对特定菌属的关注预示着未来靶向性、个性化营养的可能;而新兴益生元多来源于低成本、可再生的农业或工业副产品(如木质纤维素、果渣、甲壳素等),这使其技术路径与循环经济和绿色化学的原则高度契合。强大的市场需求也印证了其商业潜力,全球益生元市场预计到2030年将达到138亿美元,显示出强劲的商业和科研动力。
绿色催化的核心:酶驱动合成的独特优势
酶催化技术为合成新兴益生元提供了一条取代传统“复杂繁琐的化学过程”的绿色路径。其核心优势在于温和的反应条件——通常在水相介质中、于室温或中等温度下即可进行一步反应。与依赖有机溶剂、高温高压和多步保护/脱保护反应的传统化学合成相比,酶法合成在选择性、原子经济性、反应步骤和产率方面均表现出显著优越性。
酶,特别是糖苷键相关酶,具有非凡的区域选择性 (regioselectivity) 和立体选择性 (stereoselectivity)。这意味着它们可以精确地在特定位置以特定构型形成糖苷键,从而合成具有确定结构和链长的寡糖,同时避免副产物的生成。这种高选择性极大地简化了生产流程,省去了化学合成中必需的保护和脱保护步骤,从而减少了废物产生,提高了原子经济性。
果胶寡糖 (POS)
果胶寡糖是结构最多样化的新兴益生元之一,其结构复杂性源于其母体分子——果胶。果胶主要由同聚半乳糖醛酸(HG)、鼠李半乳糖醛酸-I(RG-I)等结构域构成。POS的制备主要利用富含果胶的农业副产品,如苹果渣、柑橘皮和甜菜粕。
POS的酶法生产是一个高度复杂的协同过程,需要多种酶的共同作用:
核心酶系: 主要包括作用于HG主链的聚半乳糖醛酸酶 (polygalacturonase, EC 3.2.1.15)、果胶酯酶 (pectin methyl esterase, EC 3.1.1.11) 和果胶裂解酶 (pectate lyase, EC 4.2.2.2);以及作用于RG-I等复杂区域的多种侧链水解酶。商业上常使用复合酶制剂,如来源于黑曲霉 (Aspergillus aculeatus) 的Viscozyme® L。
先进工艺: 由于POS的酶解过程易发生过度水解(生成无益生元活性的单糖)和产物抑制,过程工程的优化显得尤为重要。研究表明,采用连续错流膜生物反应器是解决这一问题的有效策略。该技术将酶促反应与膜分离相结合,能够实时移出目标分子量(如DP2-DP6)的POS产物,既保护了产物免于进一步降解,又解除了产物抑制,从而显著提高了POS的产率和反应器的生产效率。这充分说明,对于POS这类复杂产物的生产,反应器设计与酶的选择同等重要。
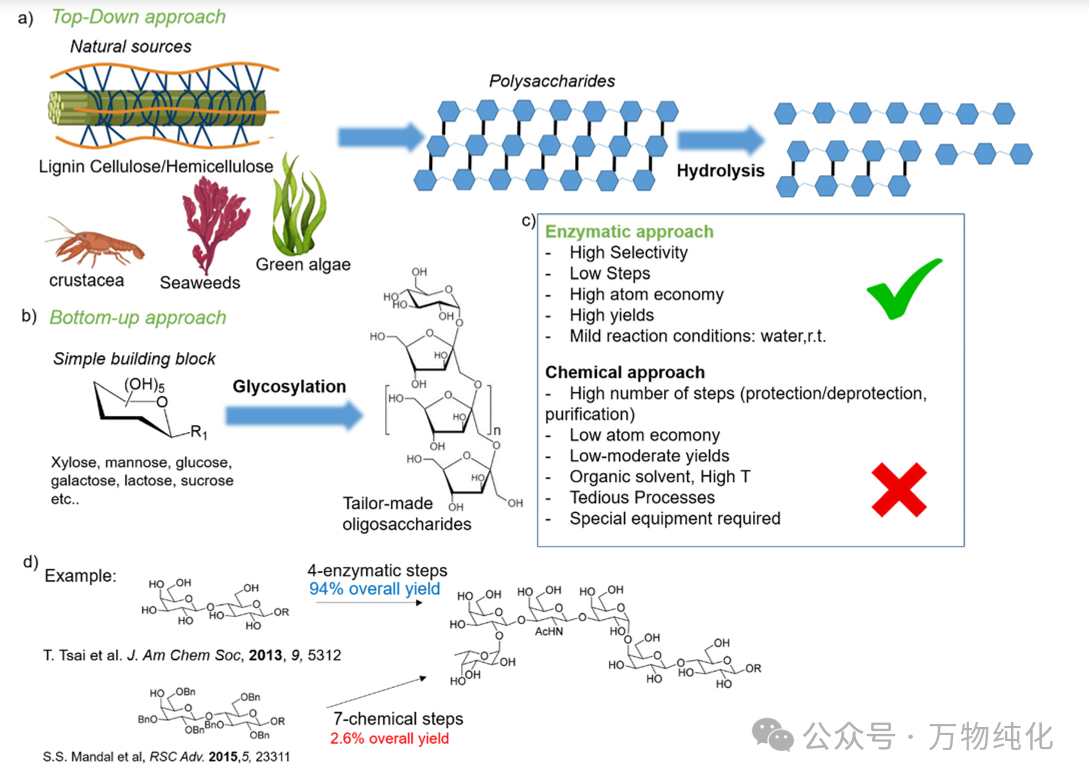
图2. 益生元寡糖绿色合成中酶法策略的优势。(a) 自上而下合成法,(b) 自下而上合成法,(c) 酶法与化学法的比较,(d) 使用酶法与化学法合成定制生物活性寡糖的实例。
一个极具说服力的例子是某六聚糖的合成:采用四步酶促反应,总产率高达94%;而传统的化学法则需要七步反应,最终总产率仅为2.6%。这种巨大的效率差距不仅体现了酶法的“绿色”属性,更重要的是,它揭示了酶作为一种赋能技术 (enabling technology) 的本质。对于许多结构复杂的寡糖而言,化学合成的低产率和高昂的纯化成本使其商业化不切实际。而酶法的高产率和高纯度则为这些高附加值功能性成分的产业化应用打开了大门。此外,酶的多功能性(即同一酶可用于多种不同反应)也催生了“平台生物催化剂”的概念,即开发少数几种稳定、高效的核心酶,通过变换底物来生产一系列不同的产品,从而极大地提高生产灵活性并降低研发成本。
新兴寡糖益生元:酶法合成技术详解
本节将详细阐述几种关键新兴寡糖益生元的酶法合成技术,重点分析其来源、核心酶系及最新研究进展。
木寡糖 (XOS)
木寡糖是由2至10个木糖单元通过 `β-1,4` 糖苷键连接而成的寡聚物,具有优异的稳定性(耐受宽范围的pH和温度)和低热量值。其酶法制备主要依赖于对富含木聚糖的生物质进行价值化利用,特别是来源广泛且成本低廉的木质纤维素,如玉米芯、甘蔗渣、麦麸等,这本身就是一项重要的废物资源化策略。
XOS的酶法合成路径分为“自上而下”的水解法和“自下而上”的合成法:
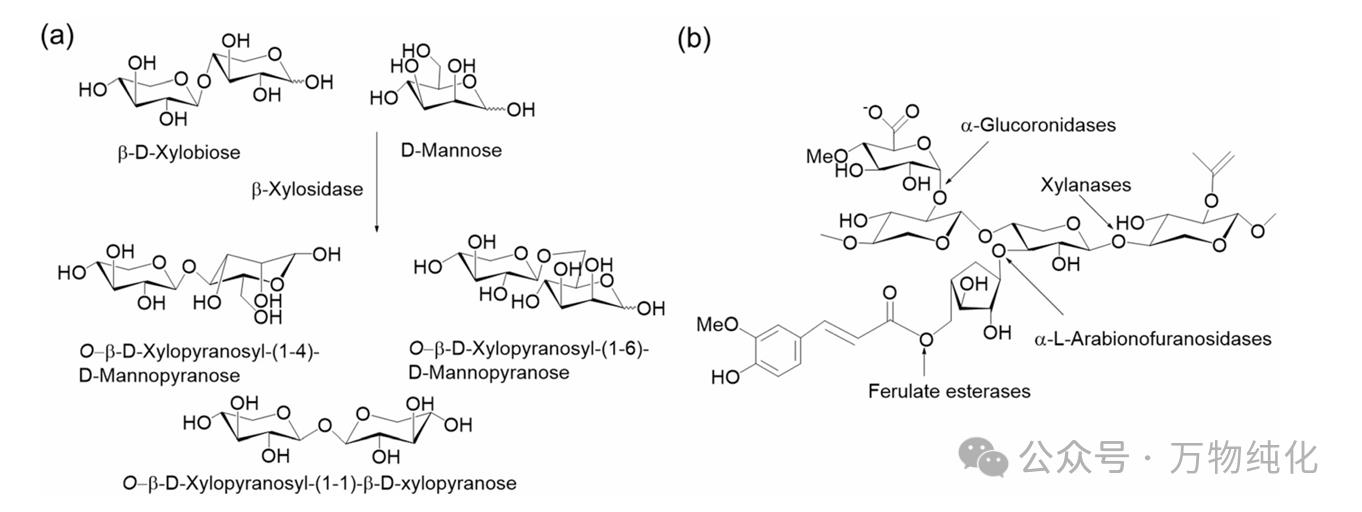
水解法 (Top-Down): 这是最主要的方法。核心酶是内切-1,4-β-木聚糖酶 (Endo-1,4-β-xylanases, EC 3.2.1.8),它能随机切断木聚糖主链。然而,天然木聚糖结构复杂,常带有阿拉伯糖、葡萄糖醛酸等侧链。因此,需要多种辅助酶协同作用,如α-L-阿拉伯呋喃糖苷酶 (α-L-arabinofuranosidases, EC 3.2.1.55) 和α-葡萄糖醛酸苷酶 (α-glucuronidases, EC 3.2.1.139),用于去除侧链,暴露主链,从而显著提高木聚糖酶的水解效率和XOS产率。研究表明,酶系的选择必须与木聚糖原料的结构相匹配,不存在“一刀切”的解决方案。例如,对燕麦糠木聚糖进行预处理,先用阿拉伯呋喃糖苷酶去除侧链,可使后续木聚糖酶的水解产率翻倍。
合成法 (Bottom-Up): 利用β-木糖苷酶 (β-xylosidase) 的转糖基活性,以木二糖等为糖基供体,木糖或其他糖(如甘露糖)为受体,通过转糖基化反应合成特定的XOS或杂寡糖。